 El campo de la electricidad es en nuestra época tan vasto
que no solamente constituye una rama del conocimiento sino que requiere del
manejo y aplicación certera de la técnica para aprovecharla a su máximo con el
fin de servirnos de ella.
El campo de la electricidad es en nuestra época tan vasto
que no solamente constituye una rama del conocimiento sino que requiere del
manejo y aplicación certera de la técnica para aprovecharla a su máximo con el
fin de servirnos de ella.
La electricidad es la base del funcionamiento desde las pequeñas
comodidades hogareñas hasta los grandes complejos industriales, acompaña al
individuo en plena sociedad y en todas sus actividades ordinarias.
Por esta razón es importante que conozcamos los principios
básicos de su naturaleza, su aplicación primordial y los elementos necesarios
de seguridad para manejarla a juicio personal sin riesgos de provocar
consecuencias que dañen nuestra salud física y el equilibrio ecológico del
medio ambiente.
La Historia de la Electricidad se remonta hasta 2500 años en la
antigua Grecia; el filósofo Tales de Mileto observó que si frotaba una varilla
de ámbar con una tela, ésta atraía papeles y pajitas y que dicho fenómeno era
de naturaleza extraña, lo cual nadie sospechaba que con el tiempo el Hombre
llegaría a dominar en su provecho.
La palabra "ámbar" significa en el idioma griego
"electrón"; El físico inglés William Gilbert dio el nombre de "eléctricos"
a los materiales que se comportaban en forma similar al ámbar, así mismo a él
se deben los términos "Fuerza Eléctrica' y "Atracción Eléctrica"
por lo que se le conoce 1 como el Padre de la Electricidad.
Fue hasta 1746 cuando Benjamín Franklin, Investigador
Norteamericano, desarrolló la primera teoría del fluido eléctrico estableciendo
que la dirección de la corriente ocurría del terminal positivo al negativo de
la fuente. Como se verá más adelante esto es un error y fue descubierto hasta que
se desarrolló la actual TEORIA ELECTRONICA, la cual echó por tierra la teoría
Frankliniana de la electricidad.
TEORÍA ELECTRÓNICA
Para comprender cuál es la naturaleza de la corriente eléctrica es
necesario que conozcamos como está constituida la materia.
Toda la materia está constituida de átomos y moléculas; Molécula
es la parte más pequeña que se puede obtener de una sustancia determinada que
conserva todas las propiedades y características físicas y químicas: si una
gota de agua la dividimos en partes cada vez más pequeñas llegaremos a la
molécula del agua con las mismas características: Incolora, Inodora e Insípida,
es decir que no tiene color, no tiene olor y no tiene sabor.
UNA MOLÉCULA ESTÁ COMPUESTA DE DOS O MÁS ÁTOMOS.
La palabra "átomo" se deriva de un vocablo griego que significa
"indivisible", aunque se demostró posteriormente que no era así;
Recientemente ha sido posible dividirlo en algunas de sus partes, que
conoceremos a continuación con la finalidad de facilitar el estudio de la
Electricidad.
Cada átomo de la naturaleza se conforma de tres clases de
partículas: En núcleo contiene los Neutrones y Protones y a su Alrededor gira a
grandes velocidades otra partícula llamada Electrón.
EL TOTAL DE ELECTRONES ES IGUAL AL DE PROTONES

NÚMERO ATÓMICO
Con el fin de identificar todos los elementos de la Naturaleza se
han cuantificado las partículas que conforman sus átomos con todas sus
características químicas y físicas individuales, enlistándolos por orden
progresivo en la 'Tabla Periódica de los Elementos" desde el número 1
(uno) hasta el 105.
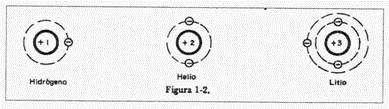
El número asignado a cada elemento se le denomina "Número Atómico"
ó Número del Átomo; Esto es así porque corresponde al número de electrones que
poseen los átomos. Así, al Hidrógeno corresponde el número uno porque solo
tiene un electrón, al Helio el número dos por la misma razón, al Cobre el
número 29, y así sucesivamente.
La Tabla Periódica de los de Elementos registra otras
características de los átomos entre otras: Nombre de los elementos, La masa del
átomo, El número de Valencia, El número de capas orbitales, Clases de los
elementos, Estado físico, etc.
PESO ATÓMICO
El peso del átomo es la suma del peso de los protones y neutrones;
En muy pocos elementos de la naturaleza el número de protones y neutrones es el
mismo, generalmente el número de neutrones es mayor que protones; Por
consiguiente, basándonos en la Tabla Periódica de los Elementos, al peso
atómico sólo se resta el número atómico y obtenemos el total de neutrones que
contiene el núcleo.
Se sabe que el neutrón tiene un peso igual al protón y éste pesa,
aproximadamente, 1,840 veces el peso del electrón.
Puesto que los átomos son eléctricamente neutros, esto es que el
número de protones es igual al de electrones, todo el peso del átomo se debe a
sus protones y neutrones ya que el peso de los electrones es insignificante.
Para tener una idea de lo anterior conozcamos los pesos
específicos de las partículas subatómicas:
* PROTÓN 1.67 x 10-24 grs. (0.000,000'000,000'000,000'000,001'67
grs)
1.67 TETRALLONESIMAS DE GRAMO
* NEUTRÓN Aproximadamente igual al protón.
*ELECTRÓN = 9.1 1 x 10-28 grs.
(0.000,000'000,000'000,000'000,000'000,91 1 gramos)
911 PENTALLONESIMAS DE GRAMO
TAMAÑO DEL ATOMO
En relación con el tamaño del átomo se sabe que es fantásticamente
pequeño; Por ejemplo se ha calculado que si se colocaran alineados 250 millones
de átomos de hidrógeno (el más pequeño de los átomos de la naturaleza) se
extenderían aproximadamente una pulgada de longitud.
Asimismo si se reunieran 100,000 protones, igualmente alineados,
abarcarían la longitud del diámetro de un átomo de hidrógeno; El protón y el
neutrón tienen aproximadamente el mismo tamaño y el electrón es un poco más
pequeño.
Se ha calculado el diámetro protón aproximadamente igual a 10-13
cm. (0.000,000'000,000'1 cm.)
Continuando con éste orden de ideas se puede concebir la distancia
que existe entre el núcleo y la órbita más cercana a éste, lo que es muy
sorprendente: la mayor porción del átomo consiste ¡en espacio
vacío!
Considere que la distancia que hay del núcleo a la órbita más
cercana (única en el caso del hidrógeno) es de aproximadamente ¡cien mil veces
el tamaño del protón!, ó también , duplicando esta distancia obtenemos el
tamaño del átomo, equivalente a ¡DOS DÉCIMAS DE MILLONÉSIMA DE CENTÍMETRO!.
En otras palabras, existe una relación de distancias de
aproximadamente de 1 a 200,000.
Comparar la estructura del átomo con el sistema solar nos ayuda a
comprender mejor las dimensiones Ínter-atómicas: El núcleo equivale al sol, un electrón
al planeta tierra que gira en torno al núcleo del sistema que es el sol.
El sol tiene un diámetro de 1'391,400 km., la tierra solo 12,756
km. y describe una trayectoria circular alrededor del sol con diámetro de
299'196,000 km. aproximadamente, es decir ¡215 veces el diámetro del sol ! y ¡
23,455 veces el diámetro de la tierra.
Como en el sistema solar, en el átomo se aprecian grandes
distancias entre las partículas que lo componen, en relación con su tamaño.
Carga eléctrica del
átomo
Se
sabe que los protones y electrones ejercen fuerzas mutuas, además de las
fuerzas de gravitación universal que existen entre ellos. Estas fuerzas se
explican adjudicando a los protones y electrones una propiedad llamada Electricidad ó carga eléctrica.
 Las
fuerzas eléctricas pueden ser de atracción ó repulsión. Los protones ejercen fuerzas de repulsión sobre otros protones; Los
electrones ejercen fuerzas de repulsión sobre otros electrones; Mientras que los protones
y electrones se atraen mutuamente.
Las
fuerzas eléctricas pueden ser de atracción ó repulsión. Los protones ejercen fuerzas de repulsión sobre otros protones; Los
electrones ejercen fuerzas de repulsión sobre otros electrones; Mientras que los protones
y electrones se atraen mutuamente.
Las
fuerzas observadas entre protones y electrones definen la regla siguiente: Cargas de la misma clase se repelen y
cargas de distinta clase se atraen.
Todos
los electrones tienen la misma carga negativa; Todos los protones tienen
exactamente la misma carga positiva; La carga de un electrón es de igual valor
de la carga de un protón aunque de polaridad opuesta.
No
se han encontrado cargas de valor menor a la de un protón ó un electrón, por
consiguiente ésta es la unidad fundamental de carga eléctrica. Los neutrones no
tienen carga eléctrica.
Además
de las fuerzas de atracción ó repulsión entre electrones y protones, que
dependen únicamente de las distancias de las partículas en el átomo, existen
otras fuerzas entre ellas que dependen de su movimiento relativo y que dan
lugar a los fenómenos magnéticos.
Por
consiguiente todos los efectos magnéticos son consecuencia del movimiento
relativo de las cargas eléctricas (de los electrones con relación a los
protones) por lo tanto, el
magnetismo y la electricidad son dos fenómenos afines que se originan como
consecuencia de las propiedades de las cargas eléctricas.
Valencia del átomo
Los átomos que tienen llena la última órbita son estables y no reaccionan con otros elementos químicos, es decir que no forman compuestos; Mientras que los átomos que no tienen completa su última capa son inestables y pueden reaccionar con otros igualmente inestables para formar compuestos encontrando así su estabilidad.
Los átomos inestables tienen desde uno hasta siete electrones en
su capa superficial, a éstos se les conoce como electrones de valencia, y para
completar hasta ocho que debe tener les hace falta desde siete hasta uno,
respectivamente, los que obtendrán de sus vecinos ó con los que se combinarán.
Los átomos que contengan más de cuatro electrones de valencia
pueden atrapar electrones; Los átomos que tengan menos de cuatro electrones de
valencia puede cederlos con facilidad; En ésta forma, al combinarse ó
reaccionar con otros igualmente inestables, alcanzan su estabilidad al formar
un compuesto, compartiendo sus electrones de valencia
Los átomos que tienen completas todas sus capas electrónicas, en
la naturaleza, son estables.
Se establece que un átomo que puede atraer electrones tiene una valencia positiva (+), un átomo que puede ceder electrones tiene una valencia negativa (-).
En general, un átomo siempre se combinará con otro con valencia de
polaridad contraria a la propia, estabilizándose ambos en la formación de un
compuesto igualmente es la propiedad del átomo para formar compuestos depende
exclusivamente de su número de valencia.
Se observa que tiene 4 capas orbitales con 2, 8, 18 y 1 electrón,
respectivamente, que suman 29 en total, por lo que su número atómico es 29, por
lo tanto tiene 29 protones en su núcleo; a la masa se le resta el número
atómico y obtenemos el total de neutrones que es 34, con número de valencia
(+)1.
De lo anterior se deduce que es un elemento eléctricamente neutro
pero químicamente inestable porque puede ceder con facilidad su electrón de
valencia.
Se han elegido a los átomos de Cobre y Oro para nuestro análisis
porque tienen características similares en relación con el número de valencia,
como se aprecia en el diagrama. El Oro presenta mayor facilidad para ceder su
electrón de valencia porque se encuentra muy alejado del núcleo y se interponen
más capas orbitales que en el caso del Cobre.
Tipos de enlace
químico
Se denomina ENLACE ó LIGADURA a la forma en que los átomos se
combinan para formar moléculas de algún compuesto y pueden ser: IÓNICA,
COVALENTE y METÁLICA.
a). ENLACE IÓNICO: Se le conoce como Enlace Iónico a la unión de dos ó más átomos
que al combinarse para formar una molécula, el átomo de valencia positiva cede
sus electrones de valencia siendo atrapados por el átomo de valencia negativa;
Durante el proceso se estabilizan químicamente, sin embargo, descomponen su
neutralidad: El primero al ceder sus electrones de valencia pierde carga
eléctrica positiva y el segundo al atrapar dichos electrones adquiere carga eléctrica
negativa.
Cuando un átomo adquiere carga eléctrica, ya sea porque pierde o
atrapa electrones, se convierte en un Ion. Por lo tanto, los átomos, combinados
en la forma arriba señalada, se convierten en Iones, razón por la cual su
unión, enlace ó ligadura se le llama IÓNICA.
Para facilitar la comprensión consideremos un compuesto químico
simple, por ejemplo el Cloruro de Sodio ó sal de mesa: Símbolo químico: NaCl
(Sodio: Na; Cloro: Cl)
El número atómico del sodio (Na) es once (11), esto es que tiene once
electrones planetarios dispuestos en tres capas como sigue: en la primera dos,
en la segunda ocho y en la última ó más alejada (superficial) sólo tiene uno,
por lo tanto tiene valencia positiva (+)1, porque puede cederlo con facilidad y
estabilizarse.
El número atómico del cloro (Cl) es diecisiete (17), esto es que
tiene diecisiete electrones planetarios dispuestos en tres capas como sigue: En
la primera tiene dos, en la segunda ocho y en la última tiene los siete
restantes, lo que le define valencia negativa (-) porque puede atraer un
electrón para completar su capa superficial y por consiguiente estabilizarse.
Ahora bien, tanto el átomo de Sodio como el de Cloro al combinarse
se han estabilizado pero en el proceso descomponen su neutralidad; Pues entonces,
el Cloro tiene un electrón más que protones, por lo tanto tiene una carga
eléctrica negativa.
Por su parte el átomo de Sodio tiene un electrón menos que sus
protones, por lo tanto adquiere carga eléctrica positiva.
Por consiguiente, los dos átomos se transforman en iones. Los
iones de cargas eléctricas opuestas se atraen mutuamente: Los iones de Sodio y
Cloro se combinan para formar una molécula de Cloruro de Sodio, mediante un enlace ó
ligadura Iónica.
b).- ENLACE COVALENTE: El átomo de
Hidrógeno contiene un electrón en su capa única, dado que la capacidad de esta
capa es de dos electrones, entonces el átomo de Hidrógeno es inestable. Por
ello cede con facilidad su electrón de valencia transformándose en un Ion
positivo y puede combinarse con un Ion negativo y formar una molécula mediante
ligadura Iónica.
Sin embargo, puede adquirir un estado estable si se combina con
otro átomo de Hidrógeno de forma que ambos compartan su electrón de valencia
adquiriendo así su equivalente a dos en sus respectivas capas. De ésta forma
los dos átomos constituyen una molécula de Hidrógeno que se mantiene unida por
los electrones que comparte.
Cuando dos átomos de un mismo elemento comparten entre sí sus
electrones de valencia forman una molécula mediante enlace COVALENTE.
c).- LIGADURA METÁLICA: Como su
nombre lo indica, es la ligadura que mantiene unidos los átomos de los metales,
tales como el cobre, oro, plata, Zinc, aluminio, etc..
Observemos al cobre: Sabemos ya que tiene un electrón de valencia
que se sostiene con muy poca seguridad; De hecho abandona con frecuencia al
átomo de origen vagando como electrón libre (los electrones libres serán
estudiados en el siguiente capítulo, por el momento, sólo se menciona para
explicación dé la ligadura metálica), éste junto con muchos otros procedentes
del gran número de átomos que constituyen un pedazo de cobre, forman una
especie de nube de electrones que anda a la deriva entre los átomos.
Hay que recordar que cuando un átomo pierde su electrón de
valencia pierde una carga negativa, y así se transforma en un ion positivo.
Como las cargas iguales se repelen los iones positivos tenderán a separarse,
sin embargo, la atracción entre ellos y la nube de electrones a su alrededor,
mantiene a los iones en su lugar; Por consiguiente, la pieza de cobre mantiene
su forma.
Existen moléculas que se forman de cientos y aún de miles de
átomos constituyendo una pieza de metal, conservada mediante la unión
metal-metal ó ligadura metálica.
Electrones libres
Como se explicó en el capítulo anterior, cuando un átomo al
combinarse pierde ó atrapa uno ó más electrones se convierte en un ion positivo
ó negativo, respectivamente; De la misma manera, un átomo sin que se combine ó
se haga reaccionar con otro (s), puede perder electrones si se somete a alguna
fuerza capaz de obligarlos a ello, con lo que se convierte también en un ion; A
éste proceso se le conoce como IONIZACIÓN.
Un átomo ionizado está eléctricamente cargado sin que haya sufrido
cambios químicos
En síntesis, la ionización no produce cambios en las propiedades
químicas del átomo pero sí un cambio eléctrico, y puede producirse de varios
modos; Como hemos visto los electrones de la ultima capa están sujetos en forma
bastante ligera y pueden ser desalojados completamente por colisión con otros
electrones ó mediante la acción de fuerzas capaces de excitarlos (Estas fuerzas
serán estudiadas más adelante) y producir el desplazamiento de dichos
electrones, a los que se les conoce como ELECTRONES LIBRES
Estos electrones pueden existir en forma independiente en el
exterior del átomo constituyendo una clase de electricidad, que estudiaremos
más adelante.
Cómo quedó dicho en el capítulo de ligadura metálica, los
electrones libres contenidos en un material sólido, constituido de millones de
moléculas de ese elemento, forman nubes de millones de ellos (uno por átomo)
estableciendo así la característica eléctrica del material en cuestión, que
estudiaremos en el capítulo "MATERIALES ELÉCTRICOS".










No hay comentarios:
Publicar un comentario